✅RoboCap: роботизированная капсула для очистки от слизи для улучшения доставки лекарств в желудочно-кишечный тракт
 |
| RoboCap: роботизированная капсула |
Аннотация
Пероральная доставка белков для лекарств ограничена ухудшающейся средой желудочно-кишечного тракта и плохой абсорбцией, что требует парентерального введения этих лекарств. Слизь просвета представляет собой начальный стерический и динамический барьер для всасывания. Чтобы преодолеть этот барьер, мы сообщаем о разработке RoboCap, перорально проглатываемой роботизированной капсулы для доставки лекарств, которая локально очищает слой слизи, улучшает перемешивание в просвете и местно откладывает полезную нагрузку лекарства в тонком кишечнике для улучшения всасывания лекарств. круглыми складками тонкой кишки, ворсинками и слизью.
Доставка ванкомицина (1,4 килодальтонов гликопептида) и инсулина (5,8 килодальтонов пептида), осуществляемая с помощью RoboCap, привела к повышению биодоступности в 20-40 раз у свиней ex vivo и in vivo по сравнению со стандартной пероральной доставкой ( Движения RoboCap по очистке и взбиванию слизи облегчаются внутренним двигателем и поверхностными элементами, которые взаимодействуют с< 0.05). Кроме того, доставка инсулина с помощью RoboCap приводила к терапевтической гипогликемии, поддерживая его потенциал для облегчения пероральной доставки лекарств, которые обычно исключаются из-за ограничений всасывания.
Введение
Несмотря на то, что это наиболее распространенный, экономически эффективный и практичный метод введения лекарств, пероральная доставка лекарств для макромолекул, включая нуклеиновые кислоты и белки, ограничена ухудшающейся средой желудочно-кишечного тракта (ЖКТ) и плохой абсорбцией (1). Лекарства должны преодолевать жесткую кислую среду желудка, растворяться в жидкости желудочно-кишечного тракта, оставаться стабильными среди динамичной кишечной микробиоты и разлагающих ферментов, проникать через вязкий слизистый барьер и избегать откачивающих насосов для достижения терапевтической биодоступности (2, 3). Субтерапевтические уровни пероральной биодоступности приводят к тому, что многие лекарства требуют альтернативных и часто более обременительных путей введения.
Например, инсулин, ежедневно необходимый миллионам больных диабетом во всем мире, представляет собой пептид с биодоступностью при приеме внутрь менее 1%, что требует подкожных инъекций, что может привести к беспокойству, боли и неадгезии, связанным с инъекциями (4-6). Альтернативно, в случае ванкомицина, небольшой молекулы, обычно используемой при серьезных грамположительных бактериальных инфекциях, пероральная биодоступность от 0,069 до 4% вынуждает к внутривенному введению, требующему дорогостоящей госпитализации (7-9). Технологии для преодоления препятствий всасывания, распределения, метаболизма и выведения, которые необходимы для превращения химических веществ-кандидатов в лекарства, предоставляют большую возможность помочь пациентам получить необходимую фармакологическую терапию и поддержать фармацевтическую промышленность в разработке более приемлемых лекарств (10).
Абсорбция, первая стадия проникновения, в основном затруднена слизистым барьером. Благодаря своим вязким, гидрофильным, частым оборотам и свойствам геля, разжижающего при сдвиге, слизь служит динамическим, стерическим и интерактивным барьером, предотвращающим попадание лекарств в просвет на поверхность эпителия (11). Ранее были разработаны микроперемешалки для перемешивания in situ, которые продемонстрировали способность увеличивать скорость всасывания и биодоступность (12). Нанобиотехнологические подходы, в том числе трубчатые микрометры, покрытые рН-чувствительными полимерами, способны к целенаправленной доставке и продемонстрировали повышенную задержку в тканях желудка и слизистой оболочке, но их применение ограничено определенными типами лекарств и не было масштабировано для крупных моделей животных или людей (13, 14). Проникающие в слизь ПЭГилированные липосомы обладают повышенной проницаемостью для тканей, хотя они требуют громоздкой оптимизации, специфичной для конкретного препарата (15). Ультразвуковые колебания (16) и низкочастотные микровибрации (17) также показали эффективность в механическом стимулировании более высоких скоростей транспортировки, но требуют более удобных режимов введения для клинического применения. Скорость переноса лекарств через вязкую слизь можно ускорить, увеличивая дисперсию лекарств, вызывая перемешивание в слое слизи и временно обнажая эпителиальный слой.
Здесь мы описываем разработку RoboCap, перорально принимаемого роботизированного устройства для доставки лекарств, которое локально очищает слой слизи, улучшает перемешивание и местно наносит полезную нагрузку лекарства для улучшения всасывания лекарства (Ролик 1). Вращательные и сбивающие движения RoboCap генерируются поверхностными элементами, предназначенными для непосредственного взаимодействия с тонкими кишечными (SI) складками, ворсинками и слизью.
Мы предполагаем, что биодоступность препарата будет значительно выше при доставке с помощью RoboCap по сравнению со стандартной пероральной доставкой. Мы проверяем эффективность RoboCap в доставке двух модельных пептидных препаратов, ванкомицина и инсулина, путем диффузии клеток Франца и тестирования in vivo на свиньях.
Результаты
Конструкция, функция и взаимодействие RoboCap с тонким кишечником
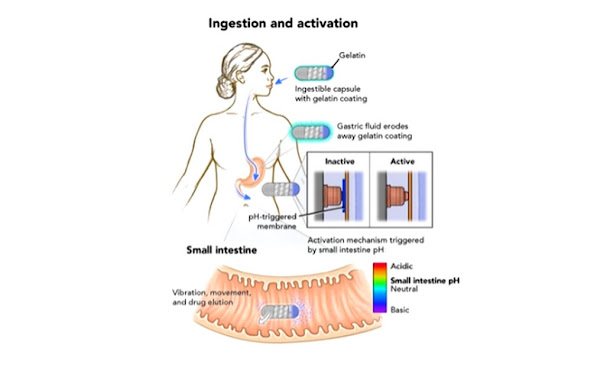
Робокап размером с капсулу с тройным нулем пригоден для приема внутрь и вмещает объем полезной нагрузки до 342,6 мм3 в грузовом отсеке (фиолетовый компонент на фиг. 1C и 2A). Желатиновое покрытие скрывает структуру поверхности, предотвращая истирание или дискомфорт при глотании (рис. 1А). Затем, во время прохождения в желудке, желудочная жидкость разрушает это желатиновое покрытие, обнажая особенности поверхности RoboCap (рис. 1А). При достижении тонкой кишки рН кишечной жидкости запускает растворимую активирующую мембрану, замыкая бортовую цепь для запуска RoboCap. Внутри робокапсулы смещенный груз, установленный сбоку на двигателе, создает центростремительную силу Fc, заставляющую робокапсулу вибрировать и вращаться против поверхностного трения F cf, что вытягивает робокапсулу радиально наружу и изменяет ее направление в соответствии со смещенным весом двигателя (рис. 2B и уравнение 1).
Fc =mw e i g h t ∗ω2w e i g h t∗rw e i g h t
(1)
f=ωweight2∗pi
(2)
где ω вес - угловая скорость веса двигателя, а r вес - радиальное смещение веса от центральной оси РобоКап. Результирующая частота колебаний капсулы равна f. Колебательное движение капсулы вызвано смещением этой силы на одну сторону капсулы на xw от центра масс, что заставляет капсулу раскачиваться взад и вперед (эффект качания), когда вес перемещается с силой тяжести и против нее
∑L=Lweight+Lcapsule=0
(3)
где угловой момент L вес = i вес * ω вес и L капсула = I капсула * ω капсула
Iw e i g h t∗ωw e i g h t = −Ic a p s u l e∗Ωc a p s u l e g i v e nωw e i g h t≫Ωc a p s u l e
(4)
Рис. 1. Механизм действия RoboCap.
(A) Процесс приема и активации запускают последовательное растворение чувствительных к рН желатиновых мембран, чтобы выявить особенности поверхности и замкнуть цепь для активации RoboCap в соответствующей области желудочно-кишечного тракта. (B) Барьеры для всасывания лекарств включают слизь, плотные соединения, микробиоту тонкой кишки и другие анатомические особенности тракта. (C) вид сбоку и (D) вид робокапа в поперечном сечении. (E) Спиральные канавки на поверхности обеспечивают вращение против слизи. (F) Надрезы в форме ребер позволяют таблетке скользить и соскребать слизь с ворсинок. (G) Микротекстура, состоящая из множества шипов, впитывает слизь. (H) Лекарство, загруженное в капсулу, разрушается слой за слоем во время вращения RoboCap на поверхности просвета.
Рис. 2. Дизайн и оптимизация RoboCap.
(A) Устройство RoboCap с маркировкой всех основных компонентов. Шкала, 6,5 мм. (Б) Слева: вид сбоку РобоКап с центром тяжести и смещенным весом (синим). Справа: Вид в поперечном сечении RoboCap, показывающий основные силы, способствующие вращательному движению. (C) Геометрия поверхности для улучшения вращения, движения и взбивания включает спиральные канавки, шипы и гладкие поверхности. (D) Скорость вращения тонкой кишки свиньи ex vivo была значительно увеличена для спиральной и спиральной геометрии поверхности по сравнению с плоской или шипованной контрольной группой. (E) Скорость вращения в различных средах демонстрирует влияние фрикционных ограничений, вызванных сопротивлением жидкости, на движение. (F) Фотография крупным планом слизи, прилипшей к шипам на поверхности РобоКап. (G) Оптическое поглощение просветной жидкости в 4-сантиметровом сегменте кишечника после 30 минут обработки робокапом с шипами различной высоты. (H) Количественная оценка оптического поглощения слизи, прилипшей к робокапсулам после 30 минут вращения в тонкой кишке свиньи с различной высотой шипов. (I) Смешивание лекарства (синего цвета) в реакционной камере с RoboCap на различных частотах. (J) Диспергирование лекарственного средства (синего красителя) после доставки с помощью фиктивного контроля, спирально-рифленого робокапа или робокапа с шипами при t = 0 и 20 мин. (K-M) Численное моделирование поля напряжений слизи, прилипшей к робокапсулам, после 6 с вращения со скоростью вращения 0,5236 рад/ с.
Скорость вращения капсулы определяется сохранением импульса внутри системы. В среде без трения, поскольку двигатель, закрепленный в капсуле, вращается с весом ω, капсула будет противодействовать этому вращению с угловой скоростью Ω капсулы, пропорциональной скорости вращения двигателя и умноженной на отношение момента инерции груза, I веса, к моменту инерции капсулы, I капсула. Подробный анализ влияния силы тяжести и двигателя на движение робокапа приведен в примечании S2.
Во время вращения элементы поверхности RoboCap механически взаимодействуют с кишечными складками, ворсинками и слизью (рис. 1, E-H), чтобы улучшить доставку лекарств с помощью различных механизмов. Внешняя спираль (1,0 мм) обеспечивает оптимальный контакт со складками (от 1 до 10 мм), а закругленные прорези (0,5 мм) соприкасаются с ворсинками (от 0,2 до 8 мм), что в совокупности облегчает вращение. Контурная поверхность также максимизирует контакт с поверхностью слизистой оболочки, при этом микротекстурированные (от 200 до 300 мкм) шипы, расположенные на углубленных поверхностях, взбивают и очищают слой слизи толщиной от 500 до 800 мкм, покрывающий эпителий (18).
С каждым вращением лекарственный груз разрушается слой за слоем, осаждая частицы препарата. Робокап активен в течение ~ 35 минут и перемещается по тракту за счет перистальтики, при которой он проходит через дефекацию. Конструкция RoboCap учитывала практические соображения, обеспечивающие универсальное использование. Например, полезная нагрузка лекарственного средства расположена на одном конце капсулы, что позволяет фармацевтам легко манипулировать ею, которые могут загрузить любое лекарство по своему выбору. Кроме того, рН-чувствительность RoboCap можно настроить для воздействия на другие сегменты желудочно-кишечного тракта, изменяя свойства растворимой мембраны. Полный дизайн RoboCap представлен на рис. S8.
Оптимизация вращения
Чтобы оптимизировать вращение, мы сравнили геометрию поверхности, включающую спиральные, спиральные и шипованные элементы, с гладкой поверхностью. Скорость вращения измеряли при вращении RoboCap на свежесрезанной ткани SI. Было обнаружено, что скорость вращения значительно увеличивается с помощью спиральной канавки [6,9 ± 1,6 оборотов в минуту (об / мин), P < 0,01, двухвостый гетероскедастический t-тест], вероятно, из-за выравнивания со складками и усиления колебательного эффекта по сравнению с гладкой поверхностью (4,2 ± 1,9 об / мин).
Спиральные выдавливания (5,6 ± 1,5 об / мин, P < 0,05, двухвостый гетероскедастический t-тест) также значительно увеличили скорость вращения, хотя шипованные наружные части этого не сделали (2,6 ± 0,9 об / мин, P > 0,05, двухвостый гетероскедастический t-тест; Рис. 2, C и D, n = 20 испытаний для каждого). Таким образом, для RoboCap был выбран внешний корпус, содержащий спиральную канавку. Также были протестированы скорости вращения воздуха, воды, химуса и слизи, чтобы получить представление об ожидаемом диапазоне скоростей вращения, поскольку RoboCap сталкивается с различными средами в тонком кишечнике. Показатели были значительно различны в химусе, воде и слизи по сравнению с воздухом (P < 0,05, двуххвостый гетероскедастический t-тест; Рис. 2E, n = 5 испытаний в каждом). Однако между средами наблюдалась вариабельность менее 30%, что указывает на то, что RoboCap будет функционировать должным образом даже в самых вязких условиях. Вращение и смешивание вязкой слизи (окрашенной в красный цвет) в просветной жидкости (зеленой) можно увидеть на видео S1.
В углублениях спирального внешнего корпуса были изготовлены шипы, чтобы прерывать слои слизи, когда РобоКап касается поверхности. Шипы высотой от 200 до 800 мкм оценивались на предмет их способности впитывать и удалять слизь (рис. 2F). Мы сравнили их с положительным контролем, в котором мы вручную удаляли слизь с помощью устройства, похожего на гребень, которое 10 раз касалось ткани с постоянной силой, направленной вниз. Также оценивался отрицательный контроль, в котором слизь не удалялась и RoboCap не помещался.
После 20 мин обработки в свежесрезанной ткани SI поверхностное содержимое капсулы и просветную жидкость собирали с использованием стандартизированной техники промывки (см. Материалы и методы). Затем собранный образец оценивали с помощью спектроскопии поглощения при 330 нм, где более высокое поглощение указывало на большую концентрацию слизи, вытесненной из слизистой оболочки SI. Шипы всех длин значительно увеличивали удаление слизи и ее присутствие в просветной жидкости (P < 0,05, двуххвостый гетероскедастический t-тест, n = 9 испытаний на условие; Рис. 2, G и H). Шипы диаметром 800 мкм обеспечивали максимальное очищение и впитывание слизи. Влияние длины шипа также было подтверждено в эксперименте Franz cell, проверяющем проницаемость изотиоцианата флуоресцеина (FITC)–декстрана. Шипы значительно увеличивали проницаемость по мере увеличения их длины (P < 0,05, двухвостый гетероскедастический t-тест; фиг. S4).
Вдохновленные лопастями torpedo, мы внедрили в спиральный внешний корпус закругленные прорези, выполняющие роль турбинных ребер (рис. 1F), для создания движения вытесненной слизи в полость просвета и улучшения перемешивания жидкостей просвета. Видеосъемка этой функции демонстрирует большее перемешивание вязкой слизи (красная) в просветной жидкости (зеленая) (ролик S2).
Чтобы количественно оценить способность робокапа впитывать слизь, мы провели анализ методом конечных элементов и оценили поля смещения и напряжения слизи, взаимодействующей с вращающимся робокапом (рис. 2, K-M, и ролик S2). Численные результаты показывают, что шипованные элементы и канавки более эффективно впитывают слизь, заставляя ее вращаться вместе с таблеткой, по сравнению с гладкой поверхностью.
Улучшенное диспергирование и перемешивание
Возможности RoboCap по смешиванию были охарактеризованы путем визуализации реакционной камеры при 0, 5, 10, 20 и 30 мин с лекарством (синий порошок) и RoboCap, работающих на частотах двигателя 0 (контроль), 50, 80 и 120 Гц (рис. 2G). Измерения поглощения образцов жидкости из верхней, средней и нижней части камеры количественно показали, что RoboCap обеспечивает более быстрое растворение лекарства и большую пространственную дисперсию по сравнению с контролем (рис. S1A). Моторные частоты 80 и 120 Гц работают лучше, чем 50 Гц. Учитывая соображения мощности, в качестве рабочей частоты было выбрано 80 Гц. После удаления или уменьшения количества слизи на поверхности кишечного эпителия эта увеличенная дисперсия позволяет большему количеству клеток вступать в контакт с лекарством, тем самым увеличивая вероятность поглощения через механизмы массового транспорта и потенциального насыщения муциновых волокон (19-22).
Эрозию и диспергирование лекарственного средства на поверхностях тканей SI также оценивали с использованием ткани SI свиньи после 30 мин активности RoboCap. При доставке с помощью RoboCap лекарственное средство распределялось по большей площади поверхности по сравнению с контролем (P < 0,05) (рис. 2H). Благодаря особенностям поверхности и частоте вращения, оптимизированным для перемешивания, диспергирования и удаления слизи, мы провели ряд исследований ex vivo и in vivo для количественной оценки эффективности RoboCap в улучшении всасывания лекарств. Используя аппарат Franz cell, ванкомицин доставляли в донорскую лунку либо путем прямого разведения в донорской лунке, либо с помощью RoboCap.
Различные геометрии поверхности были протестированы на 25 независимых образцах тканей, полученных от n= 5 животных. Учитывая межживотную изменчивость свойств тканей, было рассчитано отношение проницаемости, индуцированной Робокапом, к контрольному состоянию внутри одного и того же животного. Наблюдалось, что проницаемость препарата ванкомицина увеличивалась более чем в 10 раз при доставке RoboCap (плоские или спиральные поверхности) по сравнению с контролем (P < 0,05; рис. 3А). Кроме того, капсулы со спиральной геометрией поверхности значительно превосходили капсулы с плоской геометрией поверхности (P < 0,05) (рис. 3B).
(А) Проницаемость для ванкомицина при доставке с помощью поддельной таблетки (контрольной) или RoboCap с плоской или спиральной геометрией поверхности в аппарате Franz cell на ткани свиньи SI. (B) Проницаемость нормализуется для контрольной группы и демонстрирует более чем 10-кратное увеличение эффективности при доставке лекарств с помощью RoboCap. (C) проницаемость лекарственного средства в тонком кишечнике свиньи in vivo для доставки ванкомицина с помощью поддельных (контрольных) таблеток или спиральной или плоской робокапсулы. (D) Проницаемость нормализуется до соответствующей пары в контрольной группе, демонстрируя более чем 20-кратное улучшение при доставке лекарств с помощью RoboCap. (E) уровень глюкозы в крови и (F) концентрация инсулина в крови у свиней после введения инсулина с помощью эндоскопического просветного спрея (контроль, черный) или с помощью RoboCap (экспериментальный, красный). (G) Выделение независимых секций SI для тестирования проницаемости. Эндоскопический осмотр тонкой кишки (H) до и (I) после лечения робокапом. Окрашивание гематоксилином и эозином поперечных срезов тонкой кишки после обработки препаратом, окрашенным в синий цвет, для оценки проницаемости в (J) контрольных и (K и L) случаях, получавших RoboCap. Красные линии указывают на область микроворсинок, щеточную кайму и место нахождения слизи. Индикаторные линии указывают на типичные области осаждения красителя. Линейки шкалы, 4 мм. Квадраты представляют квартили, а точки представляют отдельные измерения.
Для оценки химической стабильности RoboCap был проведен тест на химическую стойкость. Робокапсы (n = 5) с отключенными механизмами активации погружали в имитированную желудочную жидкость или имитированную кишечную жидкость на 72 часа при 37 °C. После удаления 100% капсул смогли активироваться и нормально функционировать (рис. S6). Кроме того, 10 капсул помещали в тонкую кишку свиньи не менее чем на 60 минут. После удаления 10 из 10 капсул функционировали нормально при тестировании на рабочем столе. Не наблюдалось существенной разницы в скорости вращения RoboCaps между теми, которые подвергались воздействию тонкой кишки и воздуха (контроль) (P> 0,05, двуххвостый гетероскедастический t-тест; фиг. S6). Кроме того, чтобы оценить потенциальные тепловые риски, мы постоянно использовали RoboCap в объеме 10 мл имитируемой кишечной жидкости. Температура в течение 30-минутного периода менялась менее чем на 1 ° C, не создавая термического риска для тканей SI.
Исследование in vivo
Для оценки эффективности RoboCap в облегчении доставки пептидных лекарств мы использовали модельные пептидные препараты ванкомицин и инсулин. У обезболиваемой свиньи сначала выделяли участки тонкой кишки, чтобы они служили независимыми участками тестирования, контролируя при этом специфические для животного свойства, такие как состояние гидратации, скорость перистальтики, кровяное давление и перфузия (рис. 3G). В каждую секцию помещали робокапсулы или поддельные таблетки, содержащие 100 мг ванкомицина. Затем проницаемость ванкомицина оценивали путем взятия венозной крови из брыжеечного сплетения, вытекающего из каждого участка. В соответствии с исследованиями Franz cell, RoboCaps привели к значительно более высокой проницаемости тканей, более чем в 20 раз по сравнению с контролем (P < 0,001; рис. 3C). Спиральная поверхность дополнительно продемонстрировала значительное преимущество перед гладкой внешней поверхностью при нормализации к контрольным образцам (P < 0,001; рис. 3D). Кроме того, концентрация ванкомицина значительно увеличилась в венозном брыжеечном кровоснабжении в течение 60-минутного периода при доставке с помощью RoboCap (P < 0,01), тогда как в контрольных образцах не наблюдалось тенденции (фиг. S2A).
Кроме того, мы вводили инсулин (100 Ед) через RoboCap (n = 7 животных, экспериментальный) и сравнивали его с эндоскопическим распылителем в тонком кишечнике (контроль, n = 5). Концентрацию глюкозы и инсулина в крови контролировали в течение 75-минутного периода, а введение препарата начинали через 15 минут. RoboCap значительно увеличивал биодоступность инсулина, вызывая резкое снижение уровня глюкозы в крови (P < 0,001; фиг. 3E) и повышение уровня инсулина в крови (P<0,001, n=5 животных; фиг. 3F) по сравнению с контролем (n = 5). Животные, получавшие RoboCap, продемонстрировали среднее снижение уровня глюкозы в крови на 55,54 ± 16,1 мг / дл, тогда как контрольная группа продемонстрировала отклонение на 16,6 ± 17,3 мг / дл от исходного уровня. Наблюдаемая проницаемость тканей была более чем в два раза выше, чем ранее сообщаемая проницаемость инсулина (23). Эти результаты находятся в диапазоне, аналогичном результатам других стратегий, включающих микроиглы, которые обходят слизистый барьер. Когда животных обрабатывали Робокапом, изменения уровня глюкозы в крови наблюдались в течение 15 мин и сохранялись до конца периода мониторинга. У трех животных гипогликемия (уровень глюкозы в крови <20 мг/дл) наступила через 60 мин, что потребовало инфузии декстрозы. Это указывает на стабильную и значительно повышенную скорость всасывания препарата, что делает пероральную доставку инсулина жизнеспособной для терапевтического применения с помощью RoboCap.
Чтобы визуализировать проникновение лекарств в ткани, мы инкапсулировали в РобоКап синий краситель и ввели его в ткани SI ex vivo. После 30 мин обработки ткани фиксировали, обрабатывали парафином и окрашивали гематоксилином и эозином. Можно визуализировать голубые частицы, проникающие более глубоко в микроворсинки и эпителиальные слои в тканях, обработанных RoboCaps (рис. 3, K и L, и фиг. S2) по сравнению с контрольными группами, принимаемыми перорально (рис. 3J и фиг. S2). Эти визуализации усиливают механизм очистки RoboCap от слизи и локального осаждения лекарства для поглощения эпителием.
После пероральной или эндоскопической доставки в тонкую кишку RoboCaps безопасно прошли через желудочно-кишечный тракт животного без осложнений, перфорации или обструкции в 10 из 10 испытаний. Никакой эрозии слизистой оболочки, воспаления, инфекции или гематологических осложнений не было, что было отмечено при эндоскопии (рис. 3, H и I), проведенной до и после операции RoboCap. Используя рентгенографию, мы отслеживали прохождение RoboCap через животное вместе с рентгеноконтрастными (сульфат бария) шариками, которые служат индикатором скорости моторики (рис. S3). Контрольные группы, получавшие поддельную таблетку, и те, кто получал RoboCap, прошли гранулы через 7,6 ± 2,7 и 6,3 ± 1,9 дня. При альфа-значении 0,05 не наблюдалось существенной разницы в скорости прохождения (рис. S3).
Гистологический анализ проводили на образцах поперечного сечения из контрольных (n = 9) и обработанных RoboCap (n= 16) образцов (таблица S1) слепым патологом. Эпителий, поверхностную щеточную кайму, воспаление эпителия и поверхностную пропиотическую пластинку оценивали на срезах, окрашенных гематоксилином, эозином и трихромом, для определения повреждений эпителия, вызванных эрозией слизи RoboCap. Согласно двуххвостым гетероскедастическим т-тестам, существенных различий ни в одной категории не оценивалось. Кроме того, не было достоверной разницы в уровнях отека (контроль = 1 ± 0,707, стимулированный = 0,93 ± 0,25) и воспаления (контроль = 1,33 ± 0,866, экспериментальный = 1,31 ± 0,47) между группами (P> 0,1). Эти данные подтверждают безопасность RoboCap и его легкое прохождение через желудочно-кишечный тракт. Поглощение макромолекул опосредуется абсорбирующими ворсинчатыми эпителиальными клетками, включая ранее описанную вакуолизацию (20-22), которую можно рассматривать как морфологический показатель абсорбционной активности. Ни один из контрольных образцов не продемонстрировал заметной степени вакуолизации; однако в 6 из 16 экспериментальных образцов наблюдалась выраженная вакуолизация, что свидетельствует об усиленном поглощении, связанном с активностью RoboCap (20-22).
Чтобы оценить способность RoboCap помогать в доставке более крупных молекул, мы доставляли FITC-декстран различной молекулярной массы с помощью RoboCap, на различных частотах движения и сравнивали с прямым применением (контроль). RoboCap смог значительно увеличить поглощение даже при молекулярной массе до 150 кДа, хотя наибольшее увеличение наблюдалось при 40 и 70 кДа (рис. S4). Частота внутреннего двигателя не оказала заметного влияния на скорость поглощения.
Обсуждение
Это исследование демонстрирует полезность RoboCap для улучшения всасывания лекарств при приеме внутрь за счет локализации доставки лекарств, увеличения диспергирования лекарств и механизмов очистки от слизи. Испытания как ex vivo, так и in vivo последовательно демонстрировали более чем 10-кратное увеличение проницаемости лекарств для моделей низкомолекулярных и пептидных лекарств. Доставка инсулина с использованием RoboCap привела к более постепенному усвоению по сравнению с фармакодинамикой подкожной или внутрисосудистой инъекции, что может быть полезной особенностью для различных лекарств, требующих постепенного или длительного высвобождения. Доставка инсулина RoboCap дополнительно привела к снижению уровня глюкозы в крови у всех животных и даже вызвала непредвиденную и супратерапевтическую гипогликемию у трех из семи животных. Это подтверждает его значительный потенциал для обеспечения пероральной доставки молекул, которые ранее не имели большого успеха при пероральном введении. Будущие исследования на свиньях и людях должны оптимизировать дозировку таких лекарств, чтобы определить терапевтические диапазоны с помощью доставки SI. Повышение эффективности перорально вводимых лекарств с низкой доступностью может, в свою очередь, ограничить дозировки и тем самым повысить безопасность, соответствие требованиям и удобство, а также снизить стоимость.
В отличие от других систем-носителей лекарств, таких как препараты на основе липидов или наночастицы, RoboCap не вызывает проблем с биосовместимостью, поскольку электромеханические компоненты остаются закрытыми и проходят через организм после доставки лекарства (24). Слизистый барьер служит для защиты от патогенов; следовательно, чрезмерное выделение слизи может представлять инфекционный риск. Однако частый оборот и постоянное производство слизи не позволяют RoboCap чрезмерно истощать слизь. Это можно сравнить с более серьезными вмешательствами, разрушающими слизистый барьер, такими как полипэктомия, где побочные эффекты инфекции крайне редки (<0,2%) (25).
Конструкция капсулы может быть дополнительно усовершенствована для улучшения функции RoboCap и расширения ее полезности для других применений. Например, геометрия, которая уменьшает площадь контактной поверхности или поверхностное трение на границе капсула-жидкость, приведет к увеличению скорости вращения RoboCap. Кроме того, изменение материала или геометрии смещенного груза может увеличить инерцию капсулы, что приведет к увеличению скорости вращения. Механизм относительного вращения, при котором две стороны RoboCap вращаются в противоположных направлениях, может обеспечить повышенное перемешивание окружающей жидкости. Учитывая способность RoboCap вращаться и создавать перемешивание, он может быть адаптирован для получения пены для местного / внутрипросветного применения in situ, что в настоящее время требует эндоскопического применения (26). RoboCaps также может помочь в местном применении терапевтических средств, включая месаламин и кортикостероиды.
Клиническому переводу будут способствовать итерации дизайна для миниатюризации компонентов и проверки безопасности и эффективности. На основе соображений, включающих химическую стабильность и безопасность препарата, среду для приготовления и затраты, связанные с изготовлением и масштабированием капсул, специфичных для лекарств, RoboCap может быть загружен желаемым лекарством во время производства или фармацевтического препарата для индивидуального дозирования. Присутствие металла в таблетке может затруднить использование RoboCap у пациентов, которым требуются методы визуализации с использованием магнитов, такие как магнитно-резонансная томография. Однако другие устройства для приема внутрь, такие как PillCam, преодолели это ограничение, и такие методы могут быть адаптированы для этой капсулы.
Кроме того, в нынешней конструкции используются жесткие батареи для обеспечения достаточной мощности двигателя (~ 250 МВт). По мере развития беспроводных, безбатарейных и энергосберегающих систем они потенциально могут быть встроены для устранения жесткой электроники внутри RoboCap. Материальные компоненты RoboCap аналогичны компонентам устройств для приема пищи, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, таких как капсулы для приема внутрь с контролируемым осмотическим высвобождением (OROS), датчики температуры для приема внутрь и системы капсульной эндоскопии, что обеспечивает сопоставимые экологические соображения (27, 28). Необходимо рассмотреть системы извлечения робокапсов из выделяемых отходов, чтобы свести к минимуму потенциальные экологические осложнения, связанные с утилизацией таких компонентов в общие канализационные системы.
В заключение, как проглатываемая роботизированная капсула, RoboCap эффективно очищает слизь, улучшает перемешивание и местно наносит полезную дозу лекарства, что приводит к значительному улучшению всасывания лекарств. Как мы продемонстрировали в случае доставки инсулина, RoboCap позволяет достигать терапевтических уровней всасывания путем перорального приема лекарств, которые обычно требуют более громоздких и дорогостоящих методов, таких как подкожные инъекции, ингаляторы и внутривенное введение, требующее госпитализации.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн RoboCap
RoboCap был разработан с использованием SolidWorks. Его структура была основана на размерах капсулы с тремя нулями для облегчения перорального введения. В центральном отсеке находятся аккумулятор, резистор, двигатель (1,5 В, 3 В, миниатюрный микровибрационный двигатель без сердечника размером 6 на 10 мм, A00000308) и смещенный груз. Схема в этом отсеке замыкается при растворении полимерной мембраны, которая разлагается при рН жидкости SI. Это позволяет штырьку pogo, прикрепленному к батарее, контактировать с выводом двигателя, замыкая таким образом цепь. Во втором отсеке находится груз с лекарством, который может быть вставлен в основной отсек.
Была использована серебряно-оксидная батарея емкостью 1,55 В и емкостью 80 мА · ч (DigiKey) из-за ее биосовместимости и высокого соотношения емкости к размеру. Прототипы были напечатаны в трехмерном формате (3D) (Stratasys) с использованием фотополимера VeroClear, который был выбран за его биосовместимость, химическую стойкость и прозрачность. Капсулы перед введением тщательно промывали водой и этанолом. При подготовке к сборке детали, напечатанные на 3D-принтере, погружали в 2% раствор гидроксида натрия и перемешивали в течение 15 минут. Затем детали четыре раза промывали в деионизированной воде, прежде чем оставить сушиться. Подробная информация о сборке приведена в примечании S1.
Частота двигателя модулировалась с помощью резисторов (DigiKey) в диапазоне от 0 до 120 Ом, размещенных между батареей и двигателем (рис. S7). Частота вибрации была проверена с помощью тахометра для измерения скорости вращения смещенного груза в течение 10 секунд. Наблюдалась обратная зависимость между сопротивлением в цепи и выходной рабочей частотой RoboCap.
Различные геометрии поверхности были разработаны и протестированы на RoboCap для оптимизации вращения и разрушения слизистой оболочки. В базовой геометрии использовалась гладкая внешняя оболочка, аналогичная стандартной лекарственной капсуле с тройным нулем. Затем были добавлены рифленые и выступающие спиральные формы для увеличения скорости вращения RoboCap, вдохновленные вращающимися винтовыми механизмами. Шипованные массивы вдоль спиралей были включены для усиления взбивающего эффекта на слой слизистой оболочки SI и для дополнительной стимуляции ворсинок для поглощения лекарственного средства. Благодаря модульному характеру RoboCap эти функции были легко встроены и объединены для быстрого создания прототипов различной геометрии.
Чтобы покрыть капсулы RoboCap желатином, чтобы предотвратить активацию до попадания в тонкий кишечник, мы поместили 35% (в /в) раствор желатина (Sigma-Aldrich) в большую чашку Петри при комнатной температуре. Затем капсулы погружали в раствор примерно на 1,2 часа, пока не была достигнута желаемая толщина слоя. После извлечения капсулу несколько раз осторожно поворачивали, чтобы обеспечить равномерное распределение по поверхности таблетки, а затем оставляли застывать и сушиться при комнатной температуре в вентилируемой, но закрытой посуде. Чтобы загрузить лекарство в капсулу, мы измерили порошкообразный состав желаемого лекарства в соответствующей дозировке с помощью весов. Затем с помощью тонкой лопаточки зачерпнули и упаковали порошок в отделение для лекарств RoboCap. Затем она была запечатана и покрыта Eudragit-L, который растворяется при рН 6 в тонком кишечнике.
Эксперименты на тканях и in vivo
Все эксперименты на животных проводились в соответствии с протоколами, утвержденными Комитетом по уходу за животными Массачусетского технологического института, на модели свиней [йоркширские свиньи весом от 0 до 80 кг (Sus scrofa domesticus) в возрасте от 4 до 6 месяцев]. Модель свиньи была выбрана потому, что ее анатомия желудка похожа на анатомию человека и широко использовалась при оценке биомедицинских устройств для желудочно-кишечного тракта (29). Для стендовых испытаний, оценивающих смешивание и диспергирование, слизь собирали из тонкой кишки свиньи через рабочий канал эндоскопа. Во всех исследованиях ex vivo вскрытие кишечника выполняли в течение 10 мин после эвтаназии, а ткани поддерживали в буфере Кребса во время транспортировки. Тонкая кишка (100 см), начинающаяся от двенадцатиперстной кишки, использовалась для всех экспериментов, отдавая предпочтение проксимальным тканям, когда это возможно, для поддержания согласованности во всех экспериментах.
Чтобы охарактеризовать скорость вращения капсул различной формы, мы отметили RoboCaps в осевом направлении, и вращения подсчитывали в течение 10 минут в реакционной камере объемом 500 мл. Для одной серии испытаний реакционную камеру заполняли дистиллированной водой. Для второй серии испытаний свежесобранную ткань SI разрезали в продольном направлении и укладывали плашмя в камеру. Робокап помещали поверх толстого слоя слизи и наблюдали.
Оптимизация характеристик поверхности
Чтобы оптимизировать характеристики поверхности, мы наблюдали, как RoboCap работает со свежесобранной тканью. Шипы размером от 200 до 800 мкм оценивали на их способность очищать слизь. После 20 вращений капсулы в одном месте слизь, которая прилипла к ткани и к Робокапу, собирали с помощью трех промывок 5 мл дистиллированной воды. Поглощение раствора при 330 нм регистрировали в девяти точках в каждом из образцов при перемешивании непосредственно перед записью. Это было выполнено в трех экземплярах для каждого образца. Более высокие показатели поглощения указывают на большую концентрацию слизи в образце, что означает меньшее количество прилипшей слизи на поверхности тонкой кишки.
Характеристика диспергирования и смешивания
Желатиновые капсулы, наполненные метиленовым синим, помещали в реакционную камеру, заполненную дистиллированной водой, вместе с робокапом, работающим на различных частотах. В каждый момент времени отбирали по 2 мл жидкости из нижней, средней и верхней части 500-мл камеры. Для оценки концентрации препарата в образце была проведена спектроскопия поглощения при 435 нм. Каждый образец был измерен в трех экземплярах.
Лекарственная камера RoboCap или поддельной таблетки была заполнена синим красителем для маркировки тканей, чтобы имитировать лекарство. Спиральная РобоКап, шипованная РобоКап или фальшивая таблетка была помещена в изолированные сегменты тонкой кишки длиной 3 см. После 20 минут работы ткань вскрывали и фотографировали для измерения дисперсии.
Имитация вращения и впитывания слизи
Для характеристики взаимодействия между слизью и робокапом был проведен анализ методом конечных элементов с помощью коммерческого программного обеспечения для конечных элементов Abaqus 2021 (SIMULIA). Робокап представлял собой жесткое тело из полипропилена с плотностью 900 кг / м3, модулем Юнга 1340 МПа и коэффициентом Пуассона 0,39. Слизь была смоделирована как неньютоновская жидкость с ламинарным потоком с плотностью 1500 кг / м3. Мы использовали модель Карро-Ясуда для описания неньютоновского поведения модели при разжижении при сдвиге, где вязкость μ соответствует формуле
m u = mu∞ + (μ0-μ∞)(1+(l a m b d aγ)2)n−12
(5)
Здесь, γ˙ - скорость сдвига, а свойства модели определены в таблице 1.
Собственность Значение
Вязкость при сдвиге при низких скоростях сдвига μ 0 0.03
Вязкость при сдвиге при высоких скоростях сдвига μ∞ 0.01
Постоянная времени λ 25
Индекс поведения потока n 0.25
Таблица 1. Неньютоновские свойства слизи для модели Карро-Ясуда.
Пространство для моделирования было установлено на 40 мм (L) на 40 мм (W) на 20 мм (H), где RoboCap вращается в центре кубического пространства. Объем слизи был ограничен половиной пространства, и первоначально нижняя половина робокапса была погружена в слизь. К слизи и робокапсуле была применена сила тяжести 9,81 м/с2. Тип взаимодействия между Робокапом и слизью был установлен на “жесткий” для нормального поведения, с коэффициентом трения 0,02 для тангенциального поведения. Динамический явный решатель был реализован для моделирования первых 12 секунд взаимодействия после того, как RoboCap начал вращаться с угловой скоростью 0,5236 рад / с.
Испытание на химическую стойкость
Надежность механической конструкции и встроенной электроники была измерена путем погружения RoboCaps в моделируемую желудочную или кишечную жидкость при температуре 37 ° C. Небольшая восковая пробка закрыла входное отверстие, чтобы защитить чувствительную к рН активирующую мембрану. Через 72 часа робокапы были визуально проверены на наличие каких-либо механических повреждений. Восковую пробку удаляли, а капсулы помещали в мензурку объемом 50 мл с имитацией кишечной жидкости и наблюдали за активацией.
Термические испытания
Чтобы оценить термическую безопасность таблетки, мы поместили RoboCap во флакон объемом 10 мл с имитацией кишечной жидкости и контролировали температуру жидкости в течение 30 минут с помощью цифрового термометра.
Проницаемость тканей In vitro
Чтобы проверить функцию RoboCap и количественно оценить проницаемость тканей, мы использовали аппарат Franz cell, как описано ранее (23), с полнослойной кишечной тканью, хирургически собранной у йоркширских свиней. Ткань разделили на прямоугольные полоски, промыли 30 мл физиологического раствора для удаления содержимого пищи и поместили между двумя магнитными компрессионными пластинами для создания массива донорских и приемных лунок. Прозрачная пластиковая пленка (Thermo Fisher Scientific) использовалась для герметизации нижней пластины, создавая приемный колодец. Лунки приемника были заполнены фосфатно-буферным физиологическим раствором (PBS; Thermo Fisher Scientific) и 2% бычьим сывороточным альбумином (Sigma-Aldrich). Донорская лунка была заполнена PBS (1 ×) вместе с лекарством. Ванкомицина гидрохлорид (Sigma-Aldrich) дозировали от 1000 до 3000 мкг/ мл. Дозировка инсулина составляла от 500 до 2000 мкг / мл. В группе стимуляции RoboCaps помещали в лунки планшета на 30 минут. После обработки в лунки приемника были добавлены внутренние стандарты. Для экспериментов с ванкомицином и инсулином мы использовали блеомицин (1 мкг / мл) и лираглутид (1 мкг / мл) в качестве внутренних стандартов соответственно. Затем содержимое приемных отверстий извлекали с помощью иглы 20-го калибра. Ткани поддерживали при 37 °C и в буфере Кребса во время обработки для максимальной жизнеспособности. Все ткани были использованы в течение 1 часа с момента сбора урожая. Внутренний стандарт использовался для определения потерь из-за обработки или удаления скважин, в которых произошли утечки, и корректировки межтканевых различий.. Сигналы ванкомицина или инсулина при высокоэффективной жидкостной хроматографии (ВЭЖХ) или жидкостной хроматографии-масс–спектрометрии нормализуются до сигналов соответствующих внутренних стандартов, чтобы получить относительный отклик и повысить точность.
Исследование доставки лекарств In vivo
Чтобы измерить эффективность RoboCap по сравнению с традиционным растворением таблеток и поглощением лекарств, мы выделили 4-дюймовые срезы тонкой кишки после лапаротомии у обезболиваемой свиньи (рис. 3G). Вены в межжелудочковом сплетении были катетеризированы. Образцы крови отбирали каждые 15 минут в течение 45-минутного периода лечения. В каждую секцию кишечника, которая была отделена от соседней секции зажатой секцией тонкой кишки длиной не менее 6 дюймов, вводили RoboCaps или лекарство в жидкой форме. Каждая вторая секция оставалась пустой и необработанной в качестве буферного сегмента для предотвращения перекрестного загрязнения и / или утечки. Ткани поддерживали при физиологической температуре с помощью теплых полотенец с физиологическим раствором. Кровь центрифугировали при 4°C в течение 15 мин. В плазму добавляли ингибитор протеазы (Sigma-Aldrich) и хранили при 4°C для дальнейшего анализа.
У обезболиваемых свиней робокапсулы, наполненные инсулином, эндоскопически доставлялись в тонкую кишку. Уровень глюкозы в крови оценивали каждые 5-10 минут. Кровь собирали с помощью катетера из ушной вены и обрабатывали, как описано выше. Были измерены скорости вращения и вибрации RoboCap.
Все образцы смешивали с ацетонитрилом в соотношении 1:3 (объем / объем) и затем центрифугировали при 1200 об / мин при 4°C в течение 15 мин для осаждения и экстракции белка. Затем супернатант из каждой пробирки загружали в микротрубочки и обрабатывали с помощью ВЭЖХ для количественного определения концентрации лекарств. Концентрацию ванкомицина анализировали с помощью ВЭЖХ Agilent 1260 Infinity II, оснащенного четвертичным насосом, автосамплером, термостатируемой колонкой и детектором с ультрафиолетовой диодной матрицей (DAD). Обработка данных выходного сигнала выполнялась с использованием программного обеспечения ChemStation. Хроматографическое разделение проводили с использованием аналитической колонки Agilent Zorbax XDB C18 размером 4,6 мм на 150 мм со сферическим размером частиц 5 мкм. Разделение проводили при температуре 50°C. Оптимизированная подвижная фаза состояла из 0,1% муравьиной кислоты в воде (А) и ацетонитрила (Б). Градиентное элюирование начиналось при 100% A и 0% B, увеличиваясь до 5% A и 95% B в течение 3 мин. Общее время выполнения составило 5 мин со временем восстановления равновесия 2 мин. Скорость потока составляла 0,75 мл/мин, а объем инъекции составлял 10 мкл. Параметры DAD были следующими: поглощение, измеренное при длине волны 280 нм, полоса пропускания 4,0 нм и частота сканирования 5 Гц. Стандартные кривые были получены с использованием свежего ванкомицина или инсулина для расчета концентраций (рис. S5).
Проницаемость была рассчитана по следующей формуле в соответствии с предыдущими отчетами (23).
P=VA×C0×ΔCRΔt
(6)
где V - объем в приемной камере, A - площадь поверхности ткани, C0 - начальная концентрация в донорской камере, а Δcr - увеличение концентрации в приемной камере за время инкубации δt.
Гистология
После эвтаназии срезы ткани SI были тщательно собраны у животных в контрольной и экспериментальной группах. Ткани фиксировали в 4% параформальдегиде в течение 24 часов, промывали три раза в PBS по 15 мин каждый и хранили в 70% этаноле. Затем образцы обрабатывали парафином, заливали и делали срезы (5 мкм). Ткани окрашивали гематоксилином и эозином для оценки морфологии и наблюдения за неблагоприятными побочными эффектами, связанными с вмешательством. Образцы тканей оценивались слепым клиническим патологом на наличие отека, нарушений базальной мембраны, воспаления, вакуолизации и наличия бокаловидных клеток в соответствии со шкалами, указанными в таблице S1.
Статистический анализ
Количественные данные представлены в виде средних значений (± SD) или, при необходимости, в виде диапазона. Нормальность распределений была проверена с помощью критерия Шапиро-Уилка. Сравнительный анализ проводился с использованием гетероскедастического двухвалентного t-критерия Стьюдента, если не указано иное. P < 0,05 считался значимым.
По материалам сайта science.org



Комментарии
Отправить комментарий